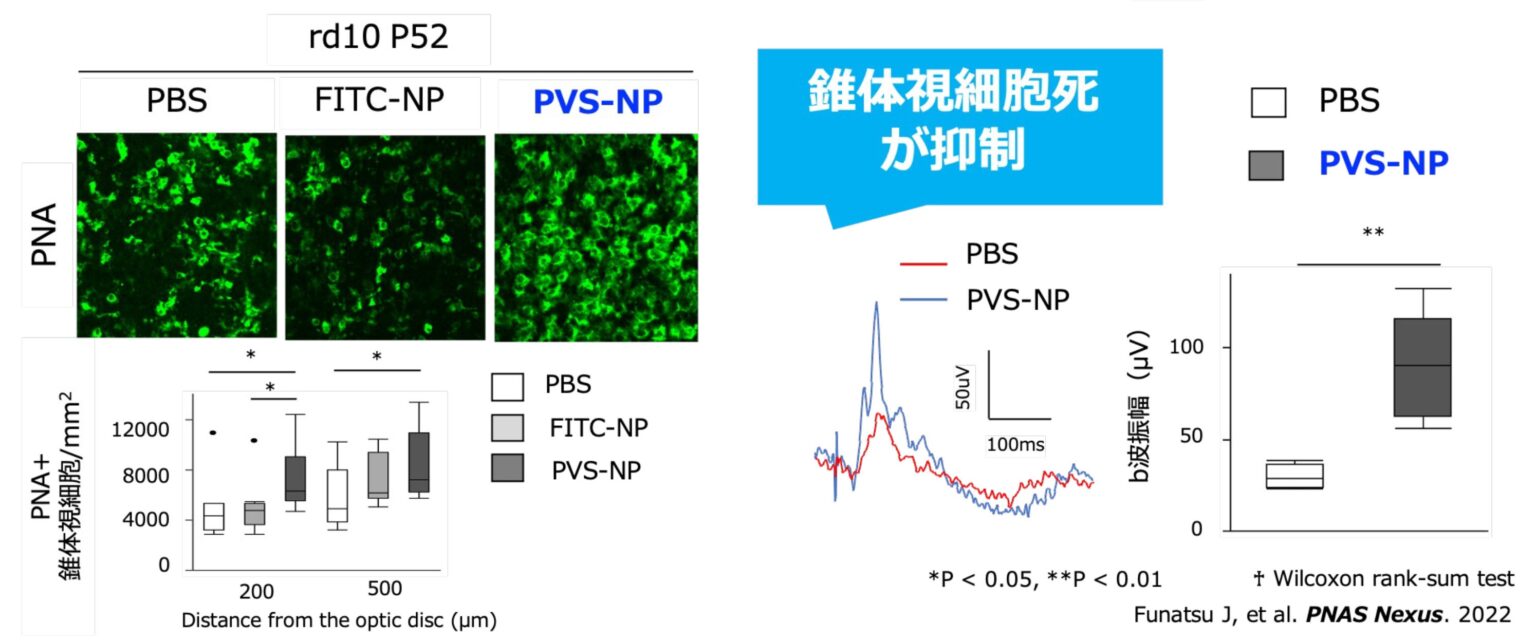
福岡市の株式会社SENTAN Pharmaは、九州大学医学部眼科(村上祐介准教授)と共同開発中の「ピタバスタチンナノ粒子・静脈内投与製剤」について、PMDA(医薬品医療機器総合機構)の対面助言を終え、治験薬のGMP製造を開始しました。2026年度に、網膜色素変性症(RP)患者を対象とした第1相の医師主導治験を始める予定です。狙いは、スタチンの抗炎症作用を生かし、網膜感度低下の進行を抑えてQOL維持につなげることです。RPは進行性の遺伝性網膜疾患で、夜盲や視野狭窄、視力低下が進み、失明に至る場合があります。原因遺伝子は約100種類と多様で、遺伝子に依存しない治療戦略が課題となってきました。同社によると、末梢血中の炎症性単球がマクロファージに分化して網膜変性を促す可能性が示されていることから、末梢血炎症性単球の活性化や神経炎症を抑える「炎症制御」を軸に開発を進めています。RPモデルマウスでは、4週に1度の投与でも錐体視細胞死を有意に抑制したデータがあるとし(Funatsu et al., 2022)、臨床段階での検証に移る構えです。ピタバスタチンは本来、高コレステロール血症治療薬として用いられるスタチン系薬剤で、抗炎症作用など多面的な作用が報告されています。SENTAN Pharmaは過去に他疾患で医師主導治験を実施してきた一方、製造コストや大量製造の難しさが課題だったとしており、安定かつ大量製造に向けた製造方法の改良でコスト低減を図ったと説明しています。PMDAとの助言を経てGMP製造に入ったことで、2026年度の第1相開始に向けた準備が進み、原因遺伝子の違いによらない治療選択肢としての実用化可否が焦点になりそうです。